技术小站 | 巨噬细胞功能分析-2
肿瘤相关巨噬细胞
上一篇说到巨噬细胞在不同组织中,具有不同的功能,并且被赋予不同的名字,其实巨噬细胞不仅仅出现在正常组织中,肿瘤相关巨噬细胞被称为TAM ( Tumor-associated Macrophages ) 。TAM是外周血单核细胞浸润到实体肿瘤组织中演变成巨噬细胞,能够表达CD11b,GR-1等。在已成熟肿瘤中,TAM刺激肿瘤迁移,并能促进肿瘤血管生成。巨噬细胞的表型及功能随着肿瘤进展的不同阶段而变化,具有双重作用:在肿瘤早期,巨噬细胞起到促进炎症反应及免疫监视作用,同时呈递肿瘤相关抗原,并具有直接抗肿瘤的细胞毒性效应,从而抑制肿瘤的发展。在肿瘤的进展期,肿瘤微环境发生了改变,其中的巨噬细胞能够促进血管生成,抑制T细胞及NK细胞活性,从而抑制免疫系统抗肿瘤效应。
根据统计,超过80%的研究显示巨噬细胞的密度和病患的预后不良相关,由于不同癌症中的TAM分泌的细胞因子以及激活TAM的细胞因子都不尽相同,因此目前认为其中起作用的是巨噬细胞相关细胞因子。在乳癌、卵巢癌、子宫内膜癌、前列腺癌、肝细胞癌和结直肠癌预后不良病例中,主要调节巨噬细胞的CSF-1出现过表达;CCL-2则在众多癌症中过表达,也与乳癌、结直肠癌和甲状腺癌的不良预后相关。帮助肿瘤生长的方向大致有几种:炎症反应、免疫调节、血管生成、血管浸润、肿瘤细胞侵袭等。例如:上调MMP和EGFR等受体表达,破坏基底膜、溶解细胞外基质,可以促进肿瘤迁移和侵袭;通过激活PDL1-PD1和CD47-SIPRα的信号通路来抑制T细胞的作用,导致其失活及组织异构;促进VEGF等因子分泌,可以促进淋巴管生成和肿瘤生长。因此控制TAM相关细胞因子或信号通路,也是治疗癌症的一种策略。
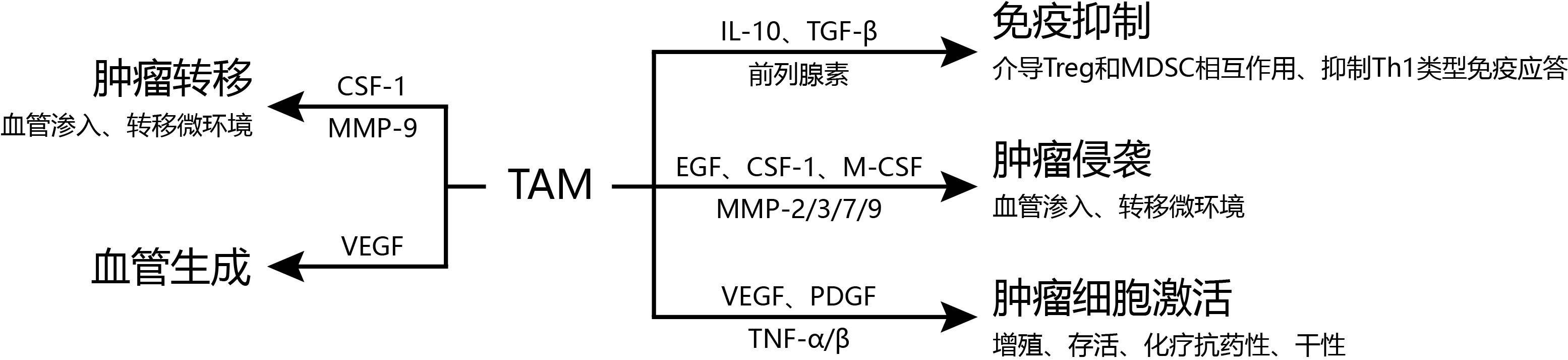
图一 TAM功能与相关细胞因子
巨噬细胞中的免疫检查点治疗
巨噬细胞主要由三种免疫检查点来抑制肿瘤细胞:CD47-SIPRα、MHCI-LILRB、CD24-siglec-10。细胞表面蛋白CD47,也称为整合素相关蛋白(IAP),是免疫球蛋白超家族的成员。除了作为整合素和血小板反应蛋白-1(TSP-1)的受体外,CD47在免疫细胞激活、细胞迁移和神经元发育等各种细胞过程中也发挥着重要作用。CD47与巨噬细胞上表达的信号调节蛋白-α(SIRPα)结合,导致肌球蛋白去磷酸化并抑制吞噬收缩吞噬机制,正常细胞向巨噬细胞呈现CD47 作为自身的标志,而衰老或凋亡细胞中,CD47表达的丧失,会导致吞噬作用的发生。CD47在多种人类癌症类型中高度表达,例如:急性和慢性髓性白血病、非霍奇金淋巴瘤、多发性骨髓瘤、平滑肌肉瘤、胶质母细胞瘤、膀胱癌、卵巢癌、肝细胞癌、前列腺癌、乳腺癌和结肠癌。研究显示,在各种小鼠模型中阻断癌细胞上的 CD47会导致巨噬细胞吞噬活性增强和肿瘤的消除。
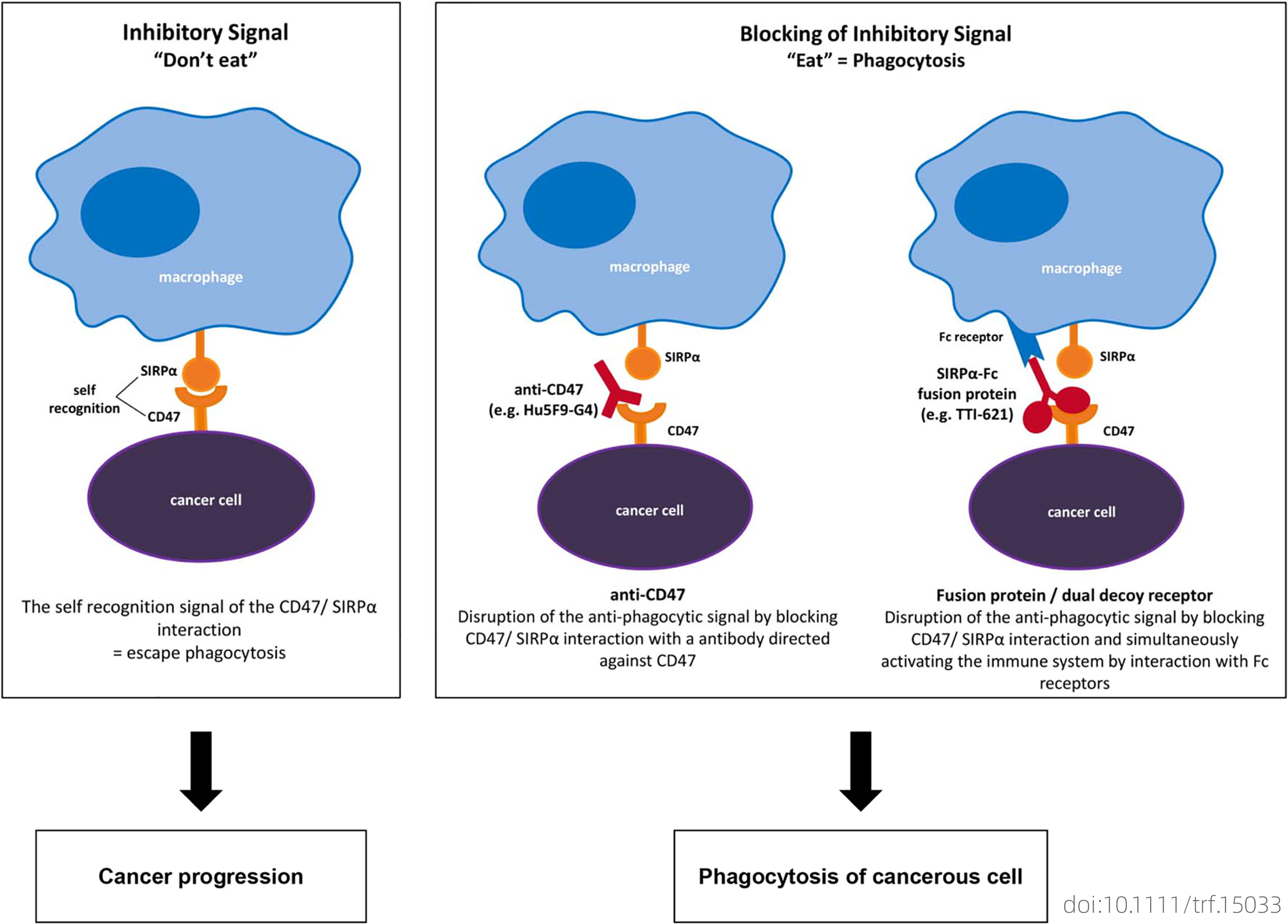
图二 CD47-SIPRα作用示意图
抑制性白细胞免疫球蛋白样受体(LILRBs)在先天免疫中起重要作用。LILRB是MHC-I类途径成分的转录调节因子,并调节先天免疫反应。此外,LILRB可以激活巨噬细胞中的Janus激酶/信号转导和转录激活因子 (JAK/STAT)信号通路基因,并诱导趋化因子和Th1、Th2和Th17细胞因子的表达。CD24是一种GPI锚定糖蛋白,位于细胞膜上。在免疫学中,CD24主要是T淋巴细胞反应的共刺激分子和自身免疫的调节剂;在癌症中,CD24调节细胞迁移、侵袭和增殖,是预后较差的病理生物标志物。CD24与 Siglec-10的结合引发抑制性信号级联反应,该级联反应由含有Src同源区2结构域的磷酸酶、SHP-1和/或SHP-2 介导。这些磷酸酶与Siglec-10细胞质尾部的两个基于免疫受体酪氨酸的抑制基序相关,从而阻断TLR介导的炎症和巨噬细胞吞噬细胞所需的细胞骨架重排。
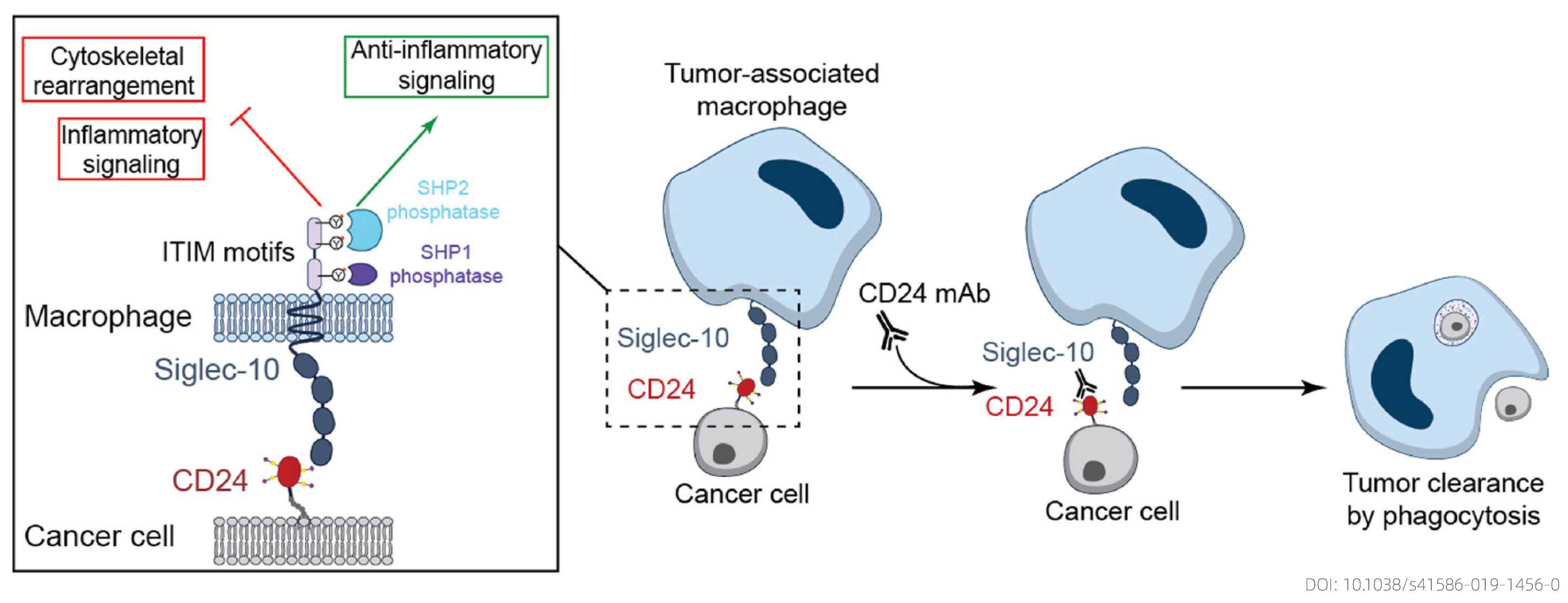
图三 CD24-Siglec-10作用示意图
巨噬细胞中的过继性免疫治疗
CAR-T、CAR-NK和CAR-巨噬(CAR-M)的CAR具有相似的结构:
1、细胞外结构域包括抗原结合结构域和参与靶细胞接合的间隔区,除了scFv,还使用了天然蛋白质/肽、细胞因子和骆驼纳米抗体;
2、跨膜结构域将CAR与免疫细胞对接,并参与CAR的其他功能,例如稳定性和与其他膜蛋白的相互作用;
3、参与信号转导和免疫细胞活化的细胞内信号结构域,除了激活免疫细胞的功能外,还使用了其他调节TME的结构域。
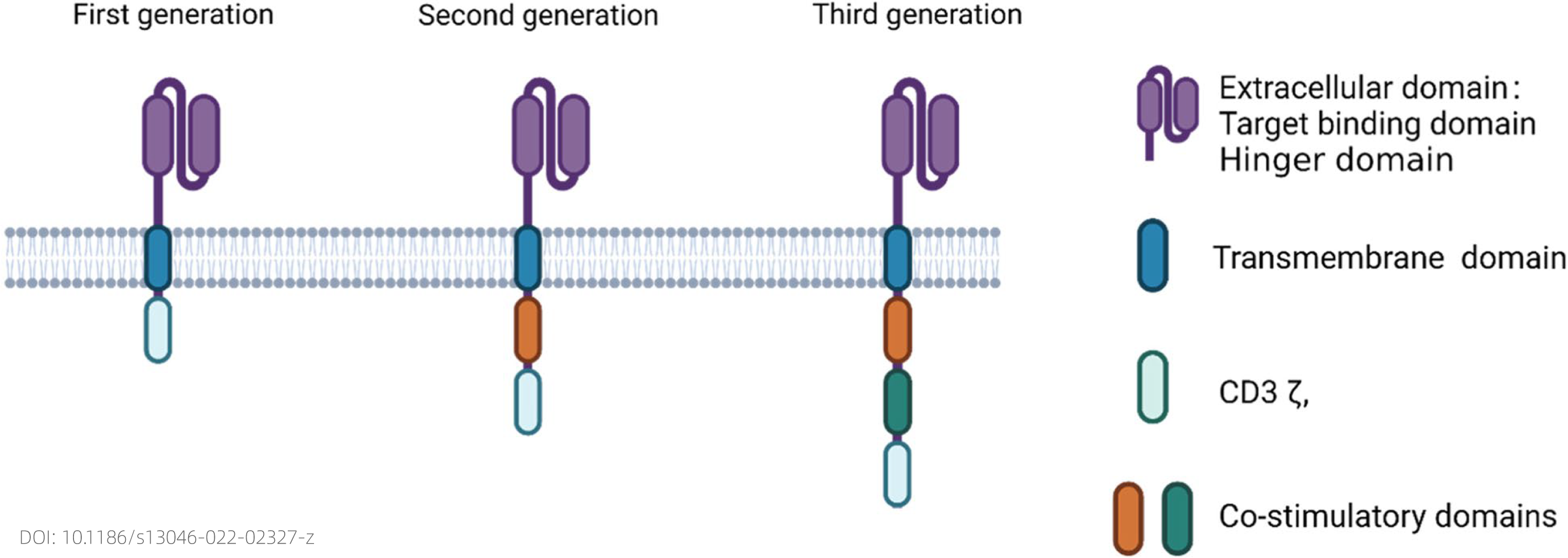
图四 第一、二、三代CAR结构示意图
三代CAR结构主要由胞内结构域的差异决定。第一代CAR包含单个CD3ζ信号域。它在CAR-T中的活性有限,因为T细胞激活需要来自与CD3的T细胞受体复合物的主要信号和来自CD28的共刺激信号。然而,第一代CAR已用于CAR-NK和CAR-M,因为不需要共刺激信号。第二代和第三代CAR与第一代的区别在于增加了一个和两个共刺激信号域。在FDA批准的CAR-T中,这些共刺激域通常是CD28或4-1BB。在CAR-NK和CAR-M中,它们的特定或其他含有ITAM的结构域用于细胞内信号传导结构域。许多实体瘤是免疫“冷”肿瘤,CAR-T和CAR-NK很少浸润到TME中,且由于免疫抑制性TME,即使在那些具有明显免疫细胞浸润的癌症中,免疫细胞也无法根除癌细胞,因此CAR-M成为一种替代疗法。前面提过,在多种肿瘤中,可以监测到较高密度的巨噬细胞,说明巨噬细胞可以被运输和浸润到TME,对TME进行免疫抑制,成为CAR-巨噬的优势。
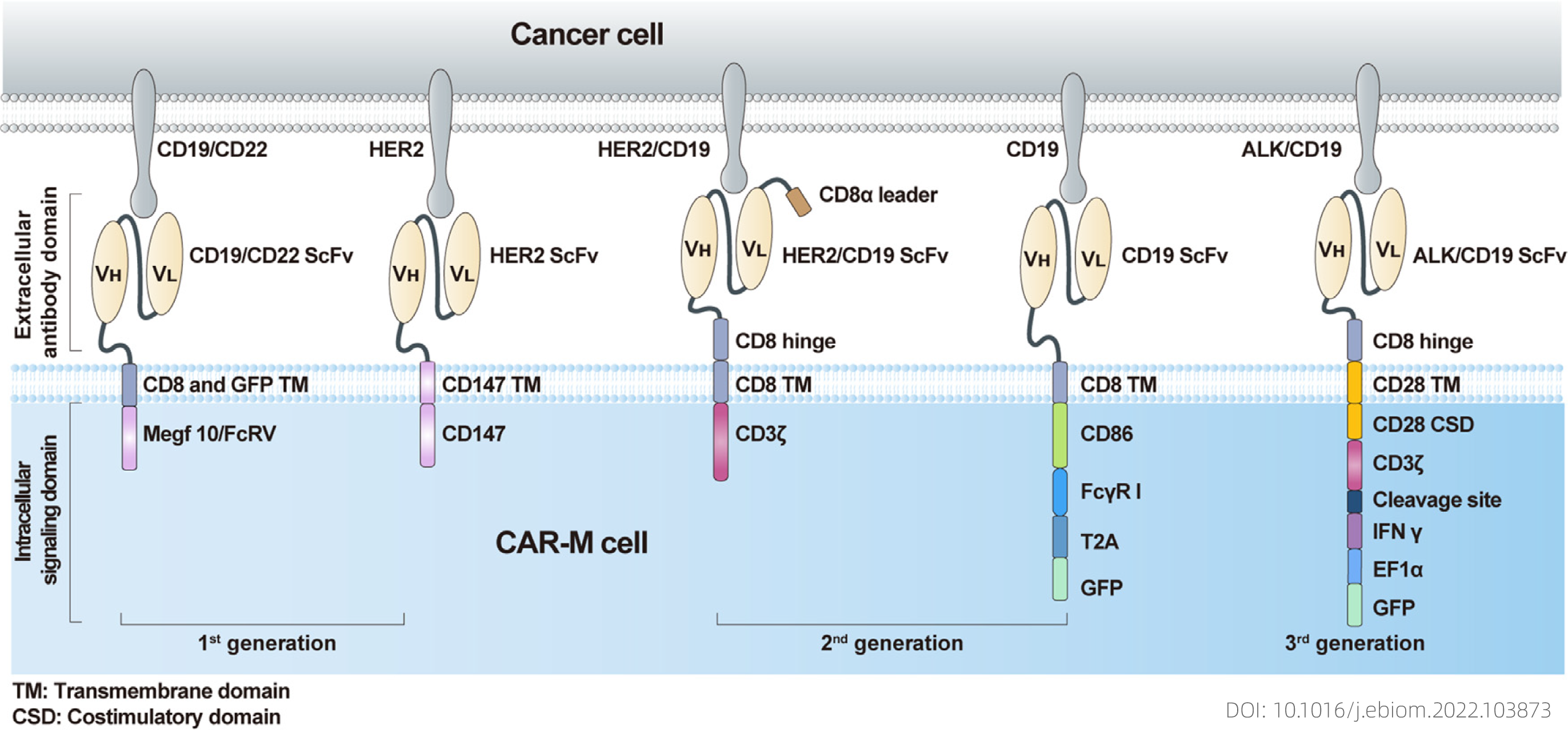
图五 第一、二、三代CAR-M结构示意图
第一代CAR-M用经过编辑的CAR进行修饰,以靶向特定抗原以识别肿瘤细胞并提高其吞噬能力。CAR-M结构主要使用独特的巨噬细胞特性——吞噬作用,构建了CAR-吞噬细胞(CAR-Ps)。接着构建了CAR-HER2-CD147来激活基质金属蛋白酶的表达,这些金属蛋白酶受CD147的刺激,可以降解肿瘤细胞外基质以克服物理障碍。
第二代CAR-M正在开发中,除了保持第一代CAR-M技术的特点外,第二代疗法的目标还包括改善肿瘤相关抗原呈递和T细胞活化,理想的方法是在CAR结构中添加细胞内胞质结构域;其次,必须考虑诱导和维持抗癌表型以克服TAM的可塑性;第三,虽然巨噬细胞不能在体外扩增,但希望CAR改造过的巨噬细胞会显著扩增并持续相对较长的时间,以在小输液剂量下达到令人满意的治疗效果。基于这些概念,研究人员试图通过嵌合载体转导工程改造鼠源或人源骨髓源性巨噬细胞表达CAR,然后在体外扩增、浓缩和纯化后获得试剂。
第三代CAR-M技术将目标定位广泛增强抗癌功效,通过非病毒载体在体内重编程CAR-M的新概念已被用于指定第三代以克服这些挑战。而且在新一代中,细胞因子受体结构域的适应也是进一步提高CAR-M产品的免疫调节和抗肿瘤能力所必需的,研究人员试图使用巨噬细胞靶向聚合物纳米载体将编码CAR和IFN-γ的基因递送到体内的巨噬细胞中,IFN-γ旨在通过将CAR-M从M2 表型重新极化为M1表型来进一步增强抗肿瘤效力。
我们提供
1、不同类型巨噬细胞——混合型、M1型、M2型,可长期回招志愿者,确保实验长期稳定性;
2、CD14+单核细胞含量高 / 经磁珠分选的CD14+细胞;
3、定制特定特征志愿者的巨噬细胞。
ref.
The "don't eat me" signal CD47 is a novel diagnostic biomarker and potential therapeutic target for diffuse malignant mesothelioma. Oncoimmunology. 2017 Sep 21;7(1):e1373235.
Vitamin E succinate exerts anti-tumour effects on human cervical cancer cells via the CD47-SIRPɑ pathway both in vivo and in vitro. J Cancer. 2021 May 5;12(13):3877-3886.
Characterization and functional analyses of novel chicken leukocyte immunoglobulin-like receptor subfamily B members 4 and 5. Poult Sci. 2019 Dec 1;98(12):6989-7002.
Novel insights into the function of CD24: A driving force in cancer. Int J Cancer. 2021 Feb 1;148(3):546-559.
CD24 signalling through macrophage Siglec-10 is a target for cancer immunotherapy. Nature 572, 392–396 (2019).
CAR race to cancer immunotherapy: from CAR T, CAR NK to CAR macrophage therapy. J Exp Clin Cancer Res. 2022 Mar 31;41(1):119.
CAR-macrophage: An extensive immune enhancer to fight cancer. EBioMedicine. 2022 Feb;76:103873.




