服务介绍 | 多肽药物及API免疫原性评估服务
发布时间:2025年11月05日
发布人:市场部

免疫原性是指药物及其代谢产物触发机体对自身或相关蛋白产生免疫应答或引发免疫相关事件的能力,可能影响疗效、引发副作用甚至危及生命。因此,免疫原性研究是药物研发全周期的关键环节。
2023年12月,美国FDA发布重要指南《多肽药物产品的临床药理学考量》,明确强调需高度重视多肽药物的免疫原性风险,尤其对于拟出海申报的多肽仿制药,免疫原性评估已成为不可或缺的组成部分。
一、多肽药物免疫原性检测
1. 免疫原性来源
产品和生产工艺相关杂质
- 指在多肽药物的生产或合成过程中非故意引入的杂质,如污染物、溶剂、酶、制剂组分、浸出物等,这些可能引发炎症刺激,被称为“固有免疫反应调节性杂质(IRM)”。
- 主要导致固有免疫原性风险。
肽相关杂质
- 指活性药物成分(API)序列中因氨基酸侧链修饰、截短、重复、氧化、插入或缺失等而形成的杂质。
- 可诱发适应性免疫原性风险。
- 影响其与MHC结合的能力。
- 可能激活T细胞。
2. 多肽药物FDA申报相关法规
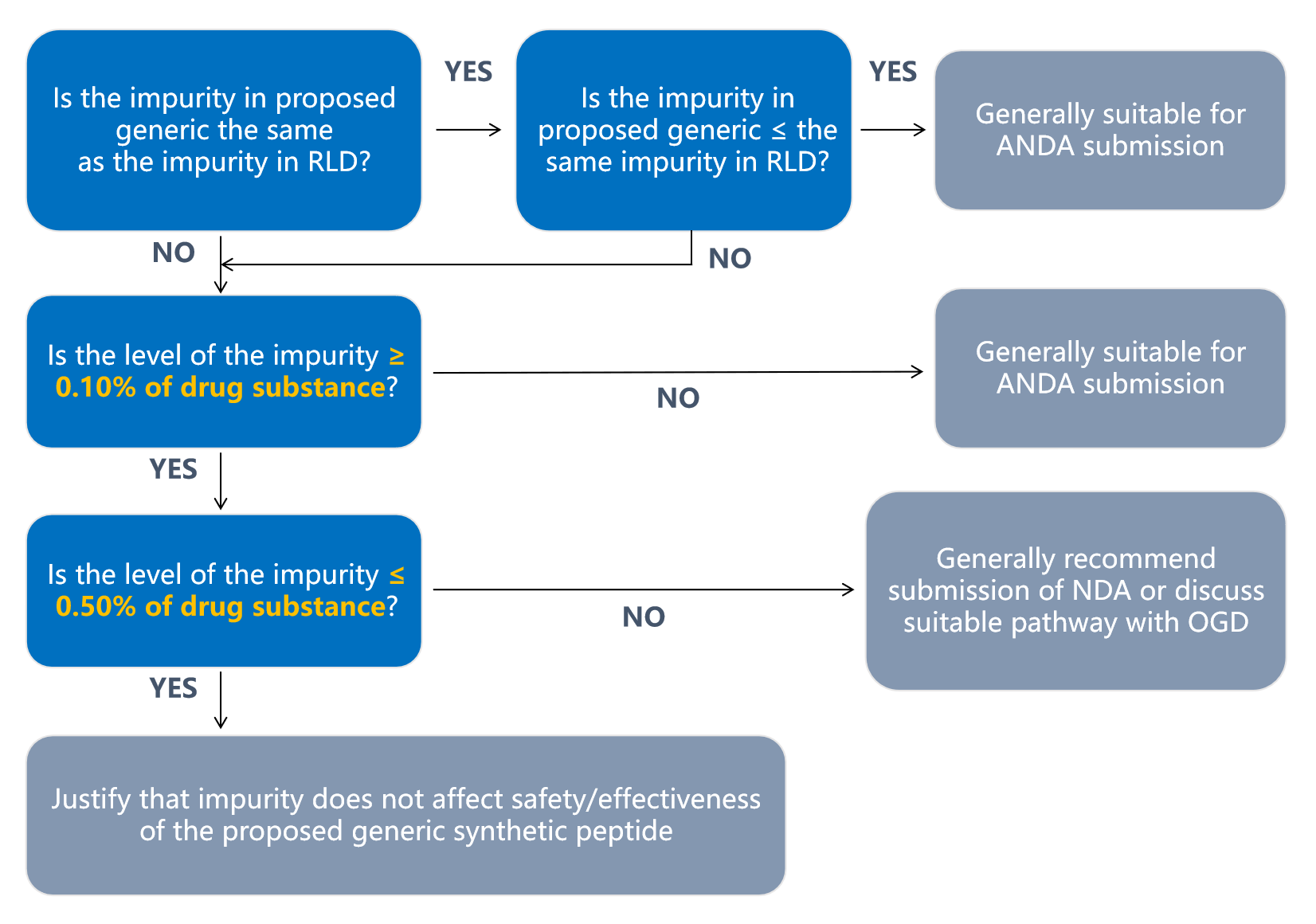
(法规示意图请参考原文件,需要法规原文可扫描底部二维码进一步咨询)
二、API免疫原性检测
“API免疫原性检测”指针对活性药物成分(API)进行免疫原性评价的过程,是多肽药物研发及上市后安全性评价的关键环节。
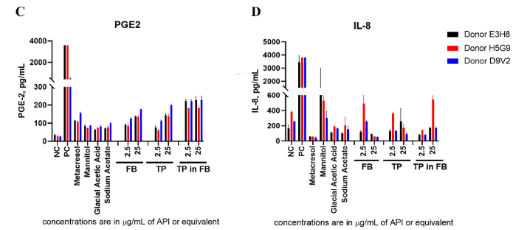
API免疫原性检测案例
针对客户制剂缓冲液(TP)处理组出现的PGE-2和IL-8升高现象,澳能通过严谨的平行对照实验设计(TP与FB独立稀释至等效浓度,辅以TP/FB稀释组及稀释液对照组),精准区分诱因源。最终数据明确显示:该细胞因子反应由制剂缓冲液(FB)触发,非API本身所致。
三、澳能生物核心优势
服务平台:流式/Luminex/Q-plex
澳能优势:千人Donor库,样本合规
- 拥有超千人庞大Donor库,HLA-DRB1全球覆盖率超90%。
- 合规采集样本,符合医学伦理审查。
- 专业成熟的免疫原性检测服务,满足申报要求。
- 严格质控:无菌检测、细胞活率、活细胞数量、细胞亚型比例等。
- 信息详实:涵盖国籍、人种、身高、体重、年龄、血型及HLA基因分型。
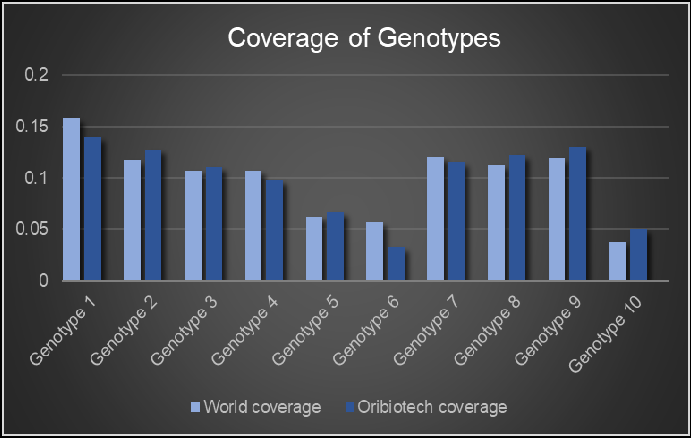
(HLA-DRB1全球覆盖率超90%)
服务经验:为多家药企提供服务
典型案例包括如下:
- 司美格鲁肽注射液免疫原性评估(首家国内CRO协助客户一次性通过ANDA申报)
- 利拉鲁肽注射液免疫原性评估
- 鲑鱼降钙素注射液免疫原性评估
- 胰高血糖素注射液免疫原性评估
- 特立帕肽注射液免疫原性评估
我们可以承接
- 四种FDA认可的免疫原性风险评估,检测药品中是否存在由IRM杂质引起的固有免疫原性风险。
- 全服覆盖FDA认可的免疫原性评估项目,识别肽相关杂质带来的免疫原性风险。
服务流程
01 筛选符合特定HLA基因型且满足覆盖率要求的供体
02 确认待测药物的细胞毒性
03 确定免疫原性检测平台
04 开展实验 → 分析数据 → 出具报告

如您有相关需求,欢迎扫码进行试用及技术人员咨询!




