ADC体外血液毒性预测服务:澳能生物CFC/CFU检测

一、背景与挑战
2024年,FDA因重大安全性风险暂停了BioNTech HER3 ADC的Ⅰ期临床试验,其高剂量组出现的致死性感染与显著的血液学毒性相关[1]。
随着原研LMWH专利陆续到期,世界范围内不断有LMWH生物类似药研发问世,一定程度减轻患者的药物支出负担。
抗体偶联药物(ADC)在肿瘤治疗领域展现出巨大潜力,目前全球已有19款ADC药物获批上市,数百款处于临床开发阶段。然而,许多ADC研发常面临血液学毒性的严峻挑战(如中性粒细胞减少症、贫血、血小板减少症),可能导致剂量调整、治疗中断,甚至造成临床患者严重感染等不良事件。
这些血液学毒性可能源于ADC对造血细胞的直接杀伤,或由其载荷在其他部位释放后的间接效应。因此,开发可靠预测临床血液学毒性的体外检测方法,对ADC的临床转化至关重要[2]。
二、解决方案:金标准CFC/CFU检测
人源克隆形成细胞(Colony-Forming Cell,CFC)检测,或称集落形成单位(Colony-Forming Unit,CFU)检测,是体外评估造血干/祖细胞功能与毒性的金标准。
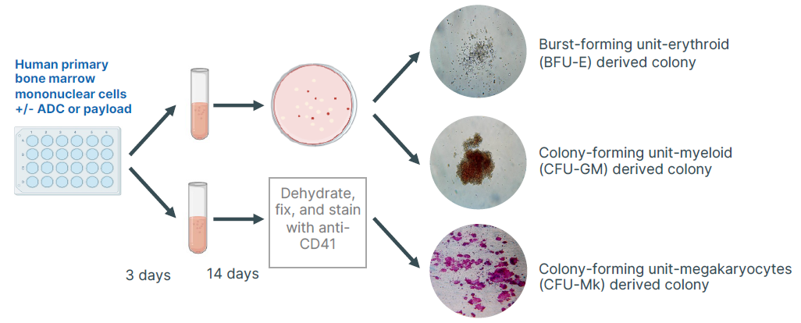
(克隆形成细胞CFC检测流程的示意图)
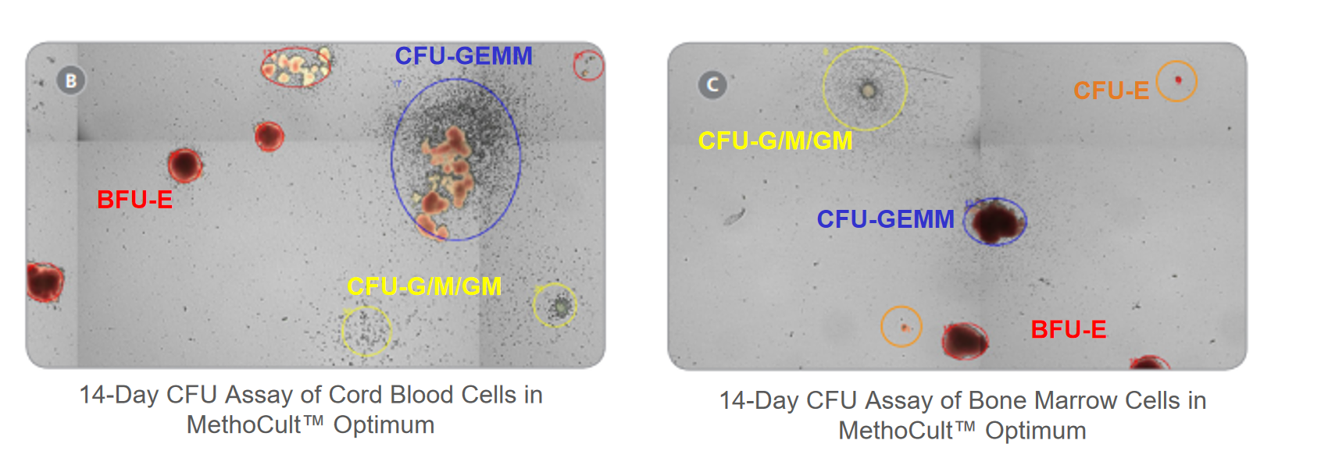
该方法将造血细胞接种于含细胞因子的半固体培养基中,祖细胞增殖分化形成特定类型的成熟血细胞集落(如CFU-E,BFU-E,CFU-G,CFU-M,CFU-GM,CFU-GEMM)。通过分析集落数量、类型和形态,可精准反映ADC及其载荷对造血系统的潜在毒性风险。
近期Zymework公开信息也证实,利用原代骨髓细胞的CFC/CFU检测能有效评估ADC血液学毒性,且有效重现了特定的临床观察结果,为药物安全性提供关键预测依据[2]。
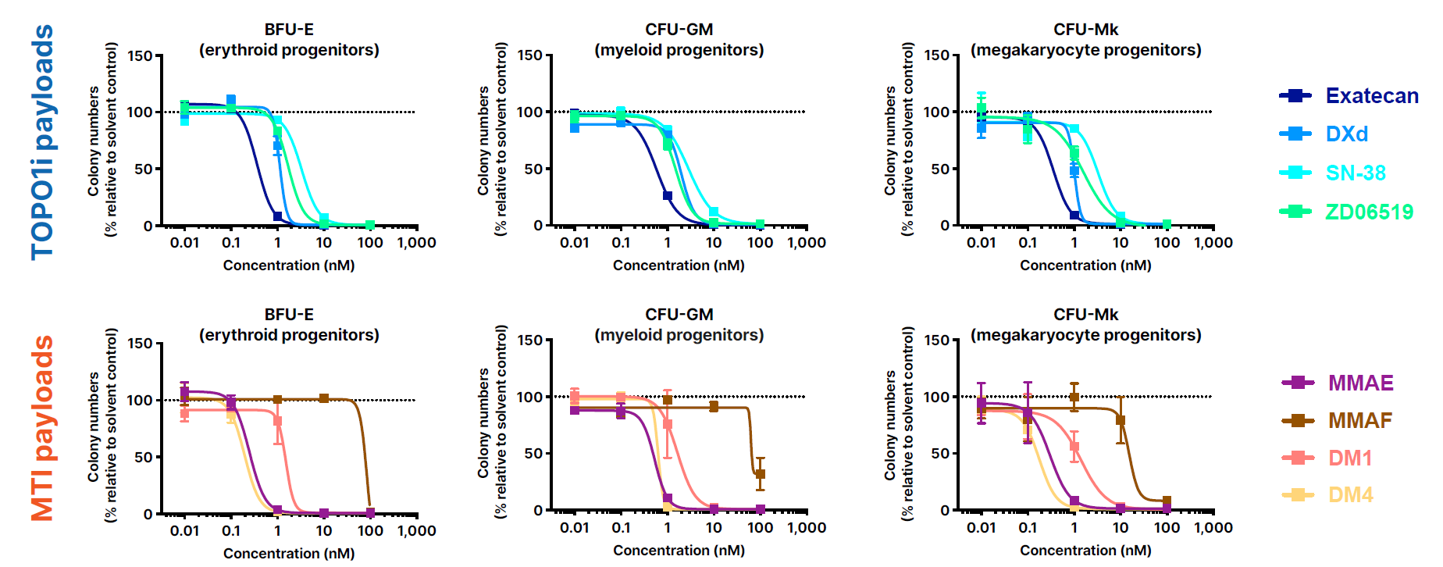
(在克隆形成细胞(CFC)检测中,游离拓扑异构酶1抑制剂和微管抑制剂载荷的体外细胞毒性)
三、澳能生物CFC/CFU检测服
澳能生物可提供专业、合规、高效的CFC/CFU检测服务,助力ADC药物安全性评估,我们的核心优势在于:
1. 优质细胞来源
拥有充足且丰富的细胞库,包括:
-
脐带血来源CD34+细胞(CB-CD34+)
-
外周血来源CD34+细胞(MPB-CD34+)
-
进口骨髓来源CD34+细胞(B-CD34+)
2. 基于STEMvision仪器的检测平台
-
自动化与高效:显著提升检测速度与结果准确性。
-
标准化与客观:智能算法精准识别和计数不同集落类型,消除人工计数主观性,确保结果高重复性。
-
合规与可追溯:数码成像永久记录原始数据,满足21 CFR Part 11等法规要求,保障数据完整性、安全性和可审计性。(对比:人工计数易出错、难以长期保存和复核)。
(STEMvision™ Harward Overview)
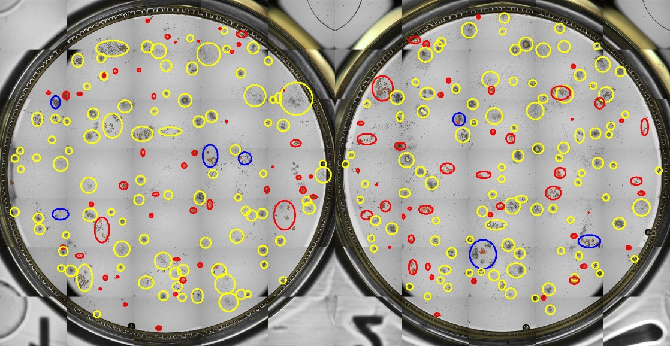
【镜下观察结果展示】
【澳能数据展示(5-FU)】
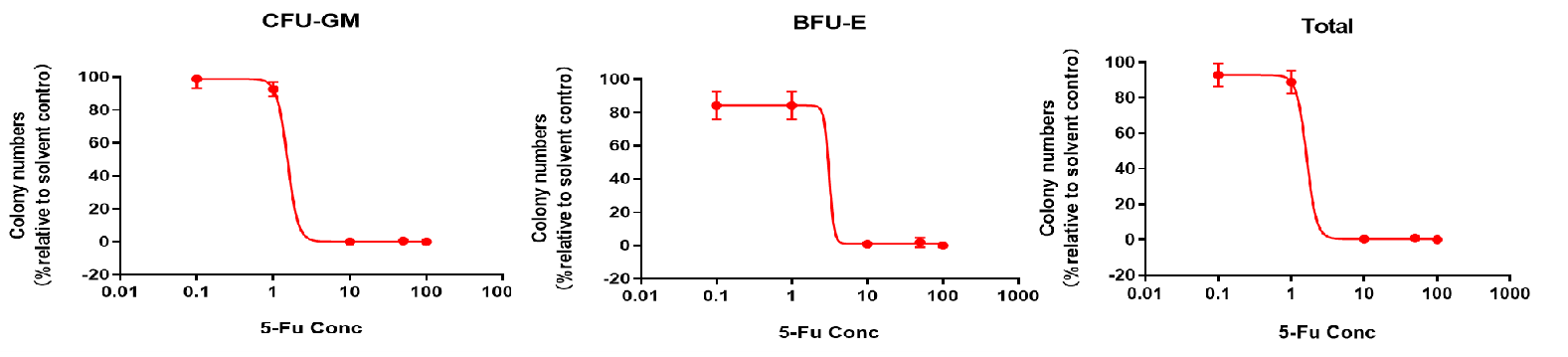
(CFC检测中体外细胞毒性)
血液学毒性是ADC研发的关键瓶颈。澳能提供的CFC/CFU检测服务,依托金标准方法和先进平台,可提供早期、可靠的体外血液毒性风险预测,成为ADC候选药物筛选与优化的重要工具,降低临床开发风险,保障患者安全。
另我司也可提供CD34+干细胞毒性基于液相试剂盒检测服务(巨核、髓系、红系等)服务,详情可进一步咨询。

如您有相关需求,欢迎扫码进行试用及技术人员咨询!




