技术小站 | 如何制备ELISpot所需的PBMC
Enzyme Linked Immunospot Assay
血液是我们身体中流动的信息之源,其中蕴含着丰富的免疫系统信息。Elispot技术作为一种有效评估T细胞和B细胞反应的方法,在研究免疫反应中发挥着关键作用。然而,在进行Elispot实验之前,必须先分离出外周血单个核细胞(PBMC)。
PBMC的分离
PBMC主要由淋巴细胞(T、B和NK细胞)和单核细胞组成,在免疫反应研究中具有重要意义。常见的PBMC分离方法——Ficoll密度梯度离心法,可以将PBMC从全血/单采血中分离出来。该方法利用了不同细胞类型的密度差异,使得红细胞和粒细胞沉淀到底部,而PBMC则形成一个清晰的环状带,俗称“白膜层”。
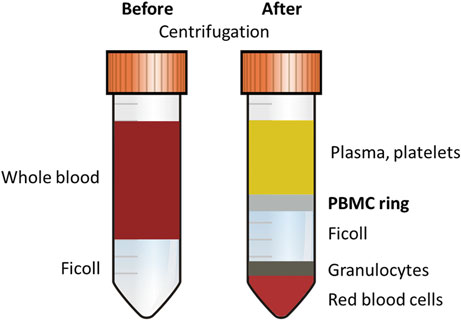
图一 血液在通过Ficoll梯度密度离心分离后,会在Ficoll层的上方出现PBMC环状带(白膜层)。doi: 10.1007/978-3-319-45295-1
分离要点
若想获得高质量的PBMC,可以通过控制制备时几个要点,来获得不错的结果:
分层清晰
Ficoll和血液必须在管子中加入而不混合在一起。可以通过在血液下方加入Ficoll,或非常缓慢和小心地将采集的血液加入Ficoll之上。[1]
温度控制
Ficoll的温度必须控制在室温范围(18-20°C)内,以确保分离效果。较低的温度会妨碍红细胞和粒细胞渗透到较高密度的Ficoll中,因此会导致PBMC回收纯度不高;较高温度下,Ficoll的密度较低,使得单个核细胞进入Ficoll层,导致PBMC的回收率降低。
降低浓度
离心前将血液加入PBS进行稀释,可以减少红细胞聚集物对PBMC分离的干扰。
时间间隔
血液采集和PBMC分离之间的时间间隔,对Elispot实验的结果至关重要。研究表明,PBMC的分离应在血液抽取后的8小时内完成,以避免粒细胞激活对分离结果产生负面影响。[2-3]
粒细胞对ELISpot的影响
稀释PBMC
粒细胞激活后改变了其浮力曲线,导致在Ficoll梯度离心过程中无法有效分离出符合ELISpot实验要求的PBMC,导致PBMC被稀释,进一步使得斑点数减少。[4-5]
破坏斑点
激活的粒细胞可能通过其Fc受体与Elispot板中的捕获抗体结合,导致斑点图像边缘出现白色点状。[6]
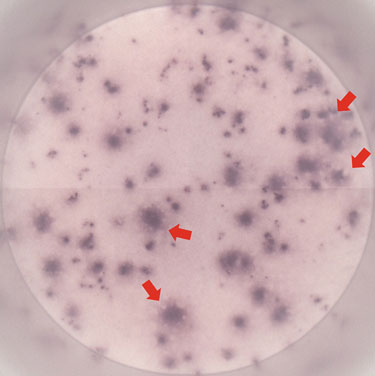
图二 ELISpot实验中的斑点周围,因粒细胞污染,出现白色破坏斑点。doi: 10.1007/978-3-319-45295-1
抑制T细胞
粒细胞激活释放过氧化氢,激活精氨酸酶,导致CD3ζ链表达的下调,从而干扰T细胞受体(TCR)信号传导,进而干扰T细胞受体信号传导,导致T细胞功能抑制。[4-5, 7-8]
PBMC for ELISpot
ELISpot 作为最为灵敏的检测技术之一,有很多的因素会对结果造成影响,尤其受到样品 PBMC 本身的质量影响,和Donor本身免疫状态影响。澳能生物作为国内一流的原代免疫细胞供应商,通过规范的招募、采集、冻存流程,保证低粒细胞的PBMC分离,并且通过ELISpot检测IFN-γ的分泌量,预先筛选对多种CD4+ 或CD8+ T细胞抗原更敏感的批次,在保证低粒细胞的同时,找出更适合进行ELISpot的PBMC。
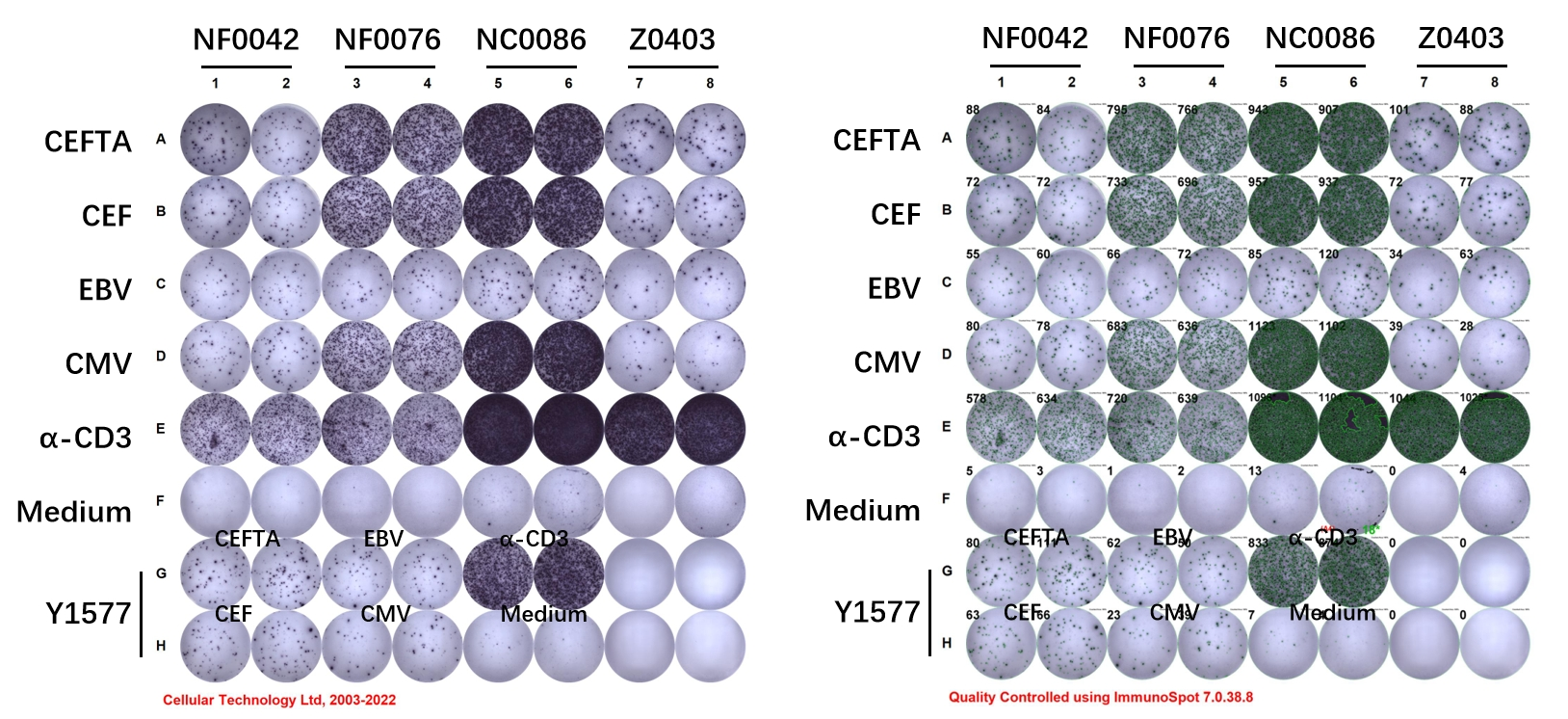
图三 ELISpot 检测不同 Donor 的 PBMC 经 T 细胞抗原刺激后的 IFN-γ 分泌情况:原始图像(左),计数图像(右)抗原:A1-A8 & G1-G2:CEFTA;B1-B8 & H1-H2:CEF;C1-C8 & G3-G4:EBV;D1-D8 & H3-H4:CMV;E1-E8 & G5-G6:α-CD3(阳性对照);F1-F8 & H5-H6:Medium(阴性对照);G7-G8 & H7-H8:空白孔。
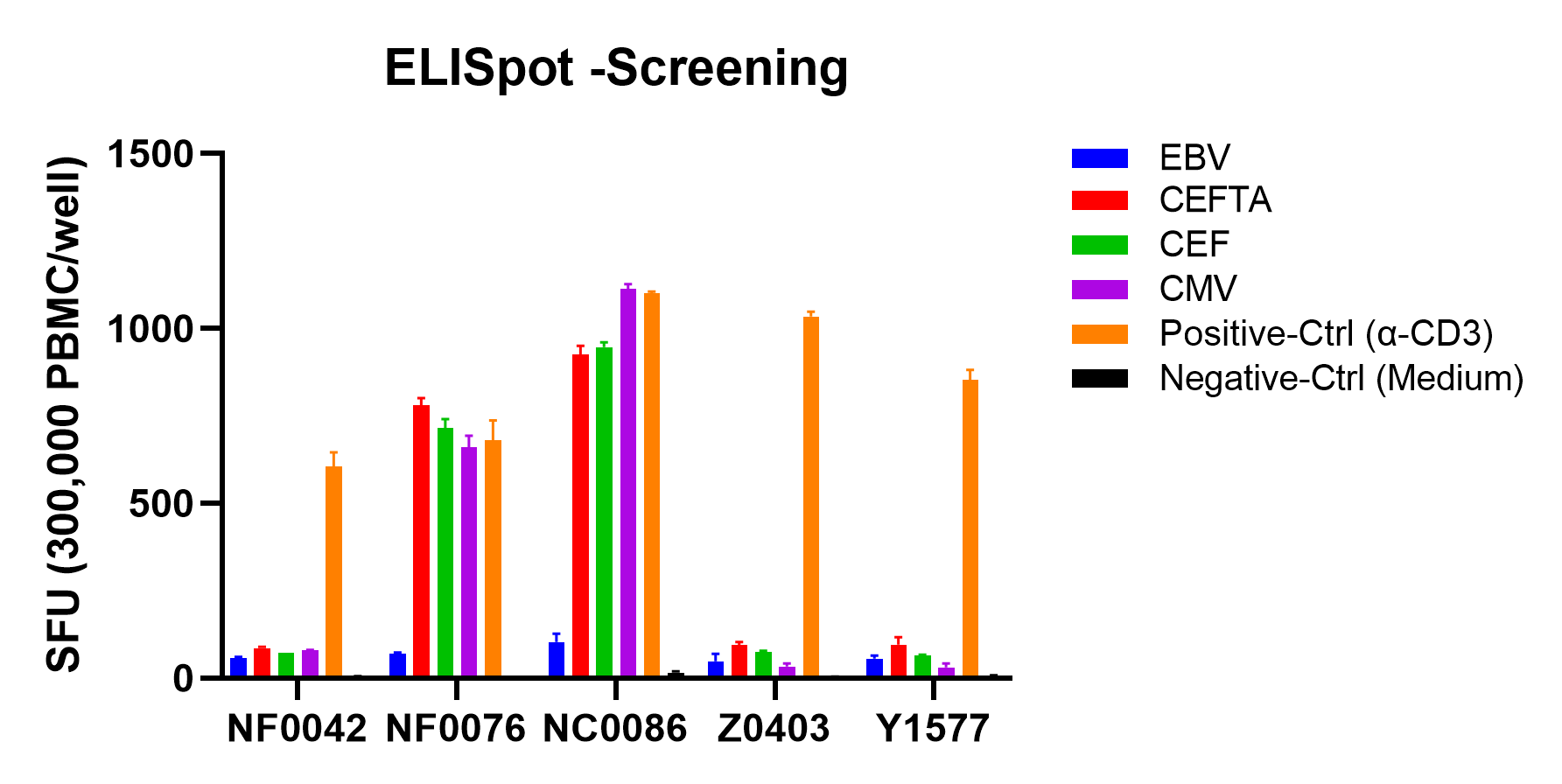
图四 ELISpot 检测不同 Donor 的 PBMC 经 T 细胞抗原刺激后的 IFN-γ 分泌情况统计图。(SFU:Spot Forming Units,斑点形成单位)
我们拥有丰富的 PBMC 优选和免疫细胞培养经验,可进行有多肽复合物的抗原递呈细胞的培养和制备,设计更加复杂也更加灵敏的 ELISpot 检测方法。
refs.
[1] Afonso G, Scotto M, Renand A, Arvastsson J, Vassilieff D, Cilio CM, et al. Critical parameters in blood processing for T-cell assays: validation on ELISpot and tetramer platforms. J Immunol Methods. 2010;359(1-2):28–36. doi: 10.1016/j.jim.2010.05.005 .
[2] Bull M, Lee D, Stucky J, Chiu YL, Rubin A, Horton H, et al. Defi ning blood processing parameters for optimal detection of cryopreserved antigen-specifi c responses for HIV vaccine trials. J Immunol Methods. 2007;322(1-2):57–69. doi: 10.1016/j.jim.2007.02.003 .
[3] Kierstead LS, Dubey S, Meyer B, Tobery TW, Mogg R, Fernandez VR, et al. Enhanced rates and magnitude of immune responses detected against an HIV vaccine: effect of using an optimized process for isolating PBMC. AIDS Res Hum Retroviruses. 2007;23(1):86–92. doi: 10.1089/aid.2006.0129 .
[4] Schmielau J, Finn OJ. Activated granulocytes and granulocyte-derived hydrogen peroxide are the underlying mechanism of suppression of t-cell function in advanced cancer patients. Cancer Res. 2001;61(12):4756–60.
[5] McKenna KC, Beatty KM, Vicetti Miguel R, Bilonick RA. Delayed processing of blood increases the frequency of activated CD11b+ CD15+ granulocytes which inhibit T cell function. J Immunol Methods. 2009;341(1-2):68–75. doi: 10.1016/j.jim.2008.10.019 .
[6] De Rose R, Taylor EL, Law MG, van der Meide PH, Kent SJ. Granulocyte contamination dramatically inhibits spot formation in AIDS virus-specifi c ELISpot assays: analysis and strategies to ameliorate. J Immunol Methods. 2005;297(1-2):177–86. doi: 10.1016/j.jim.2004.12.009 .
[7] Zea AH, Rodriguez PC, Culotta KS, Hernandez CP, DeSalvo J, Ochoa JB, et al. L-Arginine modulates CD3zeta expression and T cell function in activated human T lymphocytes. Cell Immunol. 2004;232(1-2):21–31. doi: 10.1016/j.cellimm.2005.01.004 .
[8] Zea AH, Rodriguez PC, Atkins MB, Hernandez C, Signoretti S, Zabaleta J, et al. Arginase-producing myeloid suppressor cells in renal cell carcinoma patients: a mechanism of tumor evasion. Cancer Res. 2005;65(8):3044–8. doi: 10.1158/0008-5472.CAN-04-4505 .




